En el contexto de la mecánica cuántica, en la descripción de un átomo se sustituye el concepto de órbita por el de orbital atómico. Un orbital atómico es la región del espacio alrededor del núcleo en el que la probabilidad de encontrar un electrón es máxima.
 |
| Número cuántico principal (n). |
Número cuántico principal (n): puede tomar valores enteros (1, 2, 3, 4, 5, 6, 7) y coincide con el mismo número cuántico introducido por Bohr. Está relacionado con la distancia promedio del electrón al núcleo en un determinado orbital y, por tanto, con el tamaño de este e indica el nivel de energía.
Número cuántico secundario (l): puede tener todos los valores desde 0 hasta n – 1. Está relacionado con la forma del orbital e indica el subnivel de energía.
Número cuántico magnético (ml): puede tener todos los valores desde – l hasta + l pasando por cero. Describe la orientación espacial del orbital e indica el número de orbitales presentes en un subnivel determinado.
Para explicar determinadas características de los espectros de emisión se consideró que los electrones podían girar en torno a un eje propio, bien en el sentido de las agujas del reloj o en el sentido contrario. Para caracterizar esta doble posibilidad se introdujo el número cuántico de espín (ms) que toma los valores de + ½ o – ½..
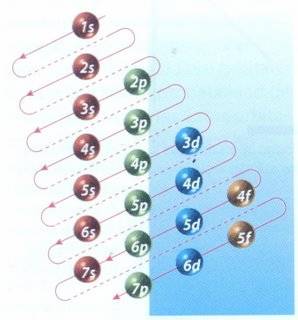 |
| Cuadro de las diagonales, mecanismo para distribuir electrones en sus diferentes niveles de energía. |
• Principio de Incertidumbre de Heisenberg: “Es imposible determinar simultáneamente la posición exacta y el momento exacto del electrón”
. • Principio de Exclusión de Pauli: “Dos electrones del mismo átomo no pueden tener los mismos números cuánticos idénticos y por lo tanto un orbital no puede tener más de dos electrones”.
Tipos de configuración electrónica
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:Configuración estándar
Se representa la configuración electrónica que se obtiene usando el cuadro de las diagonales (una de sus formas gráficas se muestra en la imagen de la izquierda).
Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Aplicando el mencionado cuadro de las diagonales la configuración electrónica estándar, para cualquier átomo, es la siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Más adelante explicaremos cómo se llega este enjambre de números y letras que perturba inicialmente, pero que es de una simpleza sorprendente.
Configuración condensada
Los niveles que aparecen llenos en la configuración estándar se pueden representar con un gas noble (elemento del grupo VIII A, Tabla Periódica de los elementos), donde el número atómico del gas coincida con el número de electrones que llenaron el último nivel.
Los gases nobles son He, Ne, Ar, Kr, Xe y Rn.