 Consiste en representar todos los electrones de un átomo empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
Consiste en representar todos los electrones de un átomo empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund. |
| Figura de un átomo sencillo ilustrando lo indefinido de sus órbitas. |
Configuración semidesarrollada
Esta representación es una combinación entre la configuración condensada y la configuración desarrollada. En ella sólo se representan los electrones del último nivel de energía.Niveles de energía o capas
Si repasamos o recordamos los diferentes modelos atómicos veremos que en esencia un átomo es parecido a un sistema planetario. El núcleo sería la estrella y los electrones serían los planetas que la circundan, girando eso sí (los electrones) en órbitas absolutamente no definidas, tanto que no se puede determinar ni el tiempo ni el lugar para ubicar un electrón (Principio de Incertidumbre de Heisenberg).Los electrones tienen, al girar, distintos niveles de energía según la órbita (en el átomo se llama capa o nivel) que ocupen, más cercana o más lejana del núcleo. Entre más alejada del núcleo, mayor nivel de energía en la órbita, por la tendencia a intercambiar o ceder electrones desde las capas más alejadas.
Entendido el tema de las capas, y sabiendo que cada una de ellas representa un nivel de energía en el átomo, diremos que:
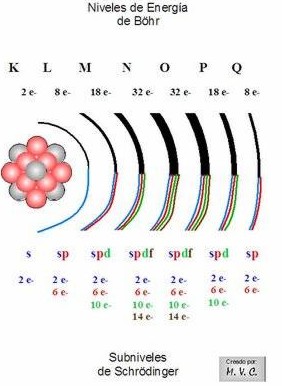
1. Existen 7 niveles de energía o capas donde pueden situarse los electrones para girar alrededor del núcleo, numerados del 1, el más interno o más cercano al núcleo (el que tiene menor nivel de energía), al 7, el más externo o más alejado del núcleo (el que tiene mayor nivel de energía).
Estos niveles de energía corresponden al número cuántico principal (n) y además de numerarlos de 1 a 7, también se usan letras para denominarlos, partiendo con la K. Así: K =1, L = 2, M = 3, N = 4, O = 5, P = 6, Q = 7.
2. A su vez, cada nivel de energía o capa tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f.
Ilustración para los niveles y subniveles de energía electrónica en el átomo | |
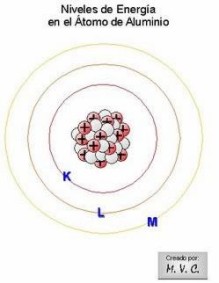 | |
| Imágenes tomadas de la página: http://configraelectrones-mvc.blogspot.com/ | |
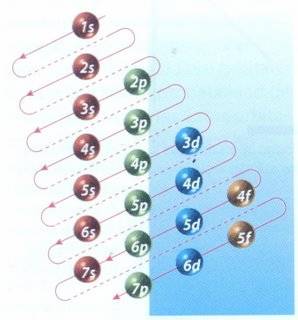
Para determinar la configuración electrónica de un elemento sólo hay que saber cuantos electrones debemos acomodar y distribuir en los subniveles empezando con los de menor energía e ir llenando hasta que todos los electrones estén ubicados donde les corresponde. Recordemos que partiendo desde el subnivel s, hacia p, d o f se aumenta el nivel de energía.
3. En cada subnivel hay un número determinado de orbitales que pueden contener, como máximo, 2 electrones cada uno. Así, hay 1 orbital tipo s, 3 orbitales p, 5 orbitales d y 7 del tipo f. De esta forma el número máximo de electrones que admite cada subnivel es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x 5); 14 en el f (2 x 7)..
La distribución de niveles, subniveles, orbitales y número de electrones posibles en ellos se resume, para las 4 primera capas, en la siguiente tabla:
| Niveles de energía o capa (n) | 1 (K) | 2 (L) | 3 (M) | 4 (N) |
| Tipo de subniveles | s | s p | s p d | s p d f |
| Número de orbitales en cada subnivel | 1 | 1 3 | 1 3 5 | 1 3 5 7 |
| Denominación de los orbitales | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| Número máximo de electrones en los orbitales | 2 | 2 - 6 | 2 - 6 - 10 | 2 - 6 - 10 - 14 |
| Número máximo de electrones por nivel de energía o capa | 2 | 8 | 18 | 32 |
Insistiendo en el concepto inicial, repetimos que la configuración electrónica de un átomo es la distribución de sus electrones en los distintos niveles, subniveles y orbitales. Los electrones se van situando en los diferentes niveles y subniveles por orden de energía creciente (partiendo desde el más cercano al núcleo) hasta completarlos.
Recordemos que alrededor del núcleo puede haber un máximo de siete capas atómicas o niveles de energía donde giran los electrones, y cada capa tiene un número limitado de ellos.
La forma en que se completan los niveles, subniveles y orbitales está dada por la secuencia que se grafica en el esquema conocido como regla de las diagonales:
Es importante saber cuantos electrones existen en el nivel más externo de un átomo pues son los que intervienen en los enlaces con otros átomos para formar compuestos.